

FUNDAMENTOS DE LA TECNOLOGÍA
DE FOTOCATÁLISIS OXIDATIVA DEL AGUA

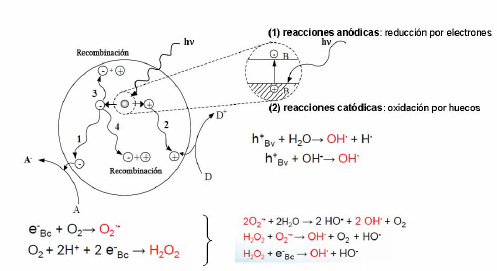
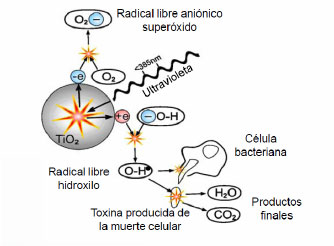
La luz ultravioleta, al incidir sobre la superficie de dióxido de titanio (TiO2), consigue la promoción de electrones de la banda de valencia del TiO2 a la banda de conducción, lo que a su vez forma un hueco positivo en dicha banda de valencia.
Tales electrones interactúan con iones hidróxido y agua para formar el radical libre •OH al final de una serie de reacciones químicas.
Así mismo, los electrones en la banda de conducción interactúan con el oxígeno molecular para formar el radical superóxido (‐O2) y peróxido de hidrógeno (H2O2) que a su vez también generan radicales •OH.

Capacidad de oxidación (REDOX)

Los radicales libres hidroxilo (•OH) son la segunda molécula más oxidante de la naturaleza, tras el Flúor (F2), con un potencial redox del orden de un doscientos cincuenta por cien (250%) el del cloro, como refleja la siguiente tabla:

velocidad de reacción
El radical libre hidroxilo (•OH) posee propiedades adecuadas para atacar virtualmente a todos los compuestos orgánicos y reaccionar de 106 a 1012 veces más rápido que oxidantes alternativos como el Ozono (O3).
La siguiente tabla muestra las constantes de velocidad de reacción de distintos compuestos con el radical libre (•OH) y con el Ozono (O3).


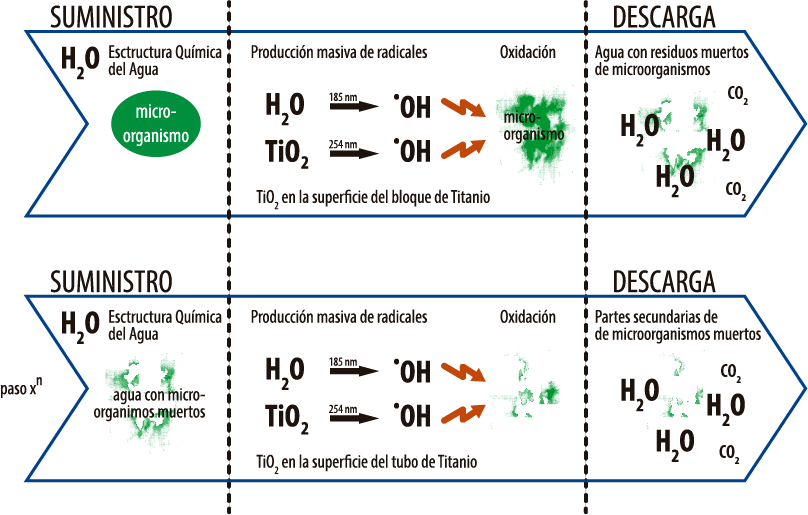
Así pues, en el reactor, se produce un intensísimo proceso de oxidación y a gran velocidad. Materia orgánica y microorganismos patógenos existentes en el agua son degradados e inactivados más rápida y más eficazmente que con cualquier otro sistema existente que se encuentre operativo hoy en día.



